
Kandungan
Peraturan ikatan kimia dikenakan kepada atom dan molekul dan merupakan asas untuk pembentukan sebatian kimia. Ikatan kimia yang terbentuk di antara dua atau lebih atom adalah daya tarikan elektromagnetik antara dua caj yang menentang. Elektron mempunyai tuduhan negatif dan tertarik kepada atau dipertahankan dalam orbit oleh nukleus atom positif yang dikenakan.
Peraturan Elektron
Fotolia.com "> • • • imej atom oleh Oleg Verbitsky dari Fotolia.comLingkaran elektron bercas negatif atau mengorbit nukleus bercas positif (jisim pusat) atom. Elektron diadakan di orbit mereka dengan tarikan kepada nukleus. Dalam pembentukan sebatian kimia, atom kedua juga menarik elektron supaya konfigurasi elektron yang paling stabil di kedua-dua atom berada di tengah. Dalam erti kata, elektron dikongsi oleh dua nukleus, dan ikatan kimia terbentuk. Ini ikatan kimia antara atom menentukan struktur bahan.
Bon Covalent dan Ionik

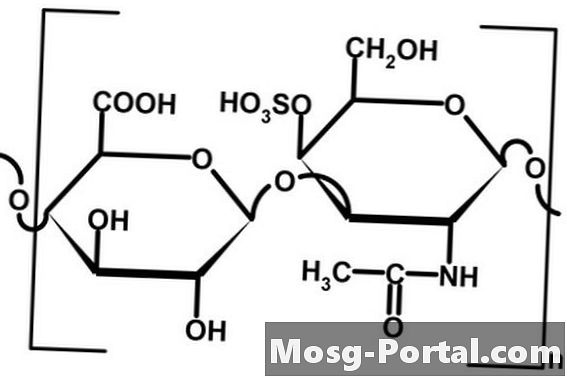
Ikatan kovalen dan ionik adalah ikatan kimia yang kuat. Dalam ikatan kovalen, elektron di antara dua atom dikongsi dan wujud di ruang antara kedua-dua nukleus. Elektron bercas negatif tertarik kepada kedua-dua nukleus, sama ada sama atau tidak sama. Perkongsian elektron tidak seimbang antara atom dipanggil ikatan kovalen polar. Ikatan ionik tidak termasuk perkongsian elektron tetapi pemindahan elektron. Satu elektron dari satu atom meninggalkan orbit atomnya, yang mewujudkan kekosongan yang membolehkan penambahan elektron daripada atom lain. Ikatan di antara atom adalah tarikan elektrostatik kerana satu atom menjadi lebih positif dan sedikit lebih negatif.
Kelemahan Kekuatan Bon

Contoh-contoh ikatan kimia yang lemah termasuk interaksi dipole-dipole, kekuatan penyebaran London, Van der Waals dan ikatan hidrogen. Dalam ikatan kovalen kutub di atas, perkongsian elektron tidak sama. Apabila dua molekul tersebut bersentuhan dan dibebaskan, terdapat interaksi dipole-dipole yang menariknya bersama-sama. Contoh lain dari pasukan molekul yang lemah, kekuatan penyebaran London, Van der Waals dan ikatan hidrogen, adalah hasil daripada atom hidrogen yang terikat kepada atom lain melalui ikatan kovalen polar. Ikatan ini lemah tetapi sangat penting dalam sistem biologi.