
Kandungan
- TL; DR (Terlalu Panjang, Tidak Baca)
- Bagaimana Mengira Moles
- Menukar kepada Mmol
- Penyelesaian Penyelesaian
- Contoh
Untuk hanya pengiraan mereka, ahli kimia mencipta unit piawai untuk bilangan atom sebatian tertentu yang terlibat dalam tindak balas atau beberapa proses kimia lain. Mereka menentukan satu mol (mole) sebagai kuantiti bahan mana-mana yang mempunyai jumlah unit yang sama seperti 12 gram karbon-12, iaitu nombor Avogadros (6.022 × 1023). Sistem SI (metrik) pengukuran mentakrifkan millimole (Mmol) sebagai satu per seribu tahi lalat. Anda secara amnya mengira jumlah tahi lalat dengan menimbang jumlah yang ada di tangan. Jika anda ingin menukar kepada Mmol, kalikan dengan 103 (1,000).
TL; DR (Terlalu Panjang, Tidak Baca)
Satu mol adalah sama dengan jumlah zarah Avogadros dari sebatian tertentu. A millimole (Mmol) adalah seribu satu tahi lalat.
Bagaimana Mengira Moles
Jisim atom diukur dalam unit jisim atom (AMU). Satu AMU betul-betul 1/12 massa nukleus atom karbon-12 dalam keadaan dasarnya. Satu tahi lalat yang ditakrifkan sama dengan jumlah zarah Avogadros zat itu. Menurut takrif ini, berat satu mol bahan dalam gram adalah bilangan yang sama dengan berat zarah individu bahan tersebut dalam AMU. Sebagai contoh, berat atom karbon-12 adalah 12 AMU, jadi satu tahi karbon-12 berat 12 gram.
Pertimbangkan satu bekas penuh gas hidrogen (H2). Setiap zarah dalam bekas adalah molekul yang terdiri daripada dua atom hidrogen, jadi anda hanya perlu tahu jisim atom hidrogen untuk mengira berat molekul. Kebanyakan versi jadual berkala menyenaraikan jisim atom setiap elemen di bawah simbolnya. Untuk hidrogen, yang mempunyai proton tunggal dalam nukleusnya, iaitu 1,008 AMU, yang merupakan purata semua isotop hidrogen yang berlaku secara semulajadi. Akibatnya, jisim gas hidrogen atom adalah 2.016 AMU, dan satu mol hidrogen gas beratnya 2,016 gram. Untuk mencari bilangan tahi lalat dalam sampel anda, anda akan menimbang sampel dalam gram dan membahagikan berat badan dengan berat molekul gas hidrogen dalam gram. Sebagai contoh, sampel seberat 15 gram gas hidrogen tulen mengandungi 7.44 mol.
Menukar kepada Mmol
Kadang-kadang kuantiti yang disiasat sangat kecil yang menyatakan mereka dalam tahi lalat adalah rumit. Masukkan millimole itu. Dengan mendarabkan bilangan tahi lalat oleh seribu, anda boleh menukar nombor yang sangat kecil kepada yang lebih mudah diurus. Ini amat mudah apabila berurusan dengan unit isipadu dalam urutan mililiter.
1 mol = 1,000 Mmol
Penyelesaian Penyelesaian
Ahli kimia menggunakan molarity sebagai ukuran kepekatan sebatian tertentu dalam larutan. Mereka mentakrifkan molariti sebagai bilangan mol setiap liter. Anda menukar molariti kepada milimolariti dengan mendarabkan sebanyak 1,000. Sebagai contoh, larutan 1 mol (molar, juga ditulis sebagai M) mempunyai kepekatan 1 mol setiap liter. Ini bersamaan dengan penyelesaian 1,000 Mmol (milimolar, kadang-kadang ditulis sebagai mM), yang mengandungi 1,000 Mmol seliter.
Contoh
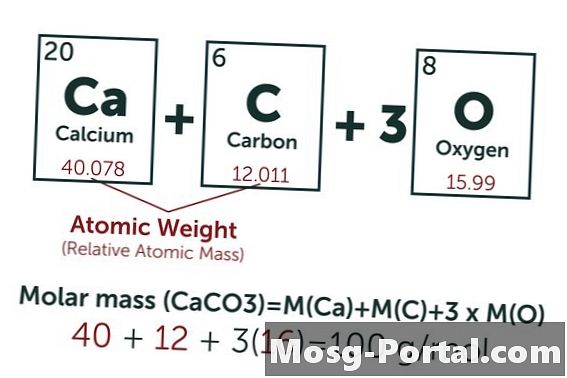
Penyelesaian mengandungi 0.15 gram kalsium karbonat. Berapa milimol itu?
Formula kimia kalsium karbonat ialah CaCO3. Berat atom karbon (C) adalah lebih kurang 12 AMU, iaitu oksigen (O) kira-kira 16 AMU dan kalsium (Ca) kira-kira 40 AMU. Setiap molekul kalsium karbonat sehingga berat 100 AMU, yang bermaksud bahawa satu tahi lalat seberat 100 gram. Berat 0.15 gram mewakili 0.15 g ÷ 100 g / mol = 0.0015 mol. Ini bersamaan dengan 1.5 Mmol.
Apakah molariti dan milimolariti kalsium karbonat dalam 2.5 liter larutan?
Molariti ditakrifkan sebagai jumlah tahi lalat setiap liter, jadi membahagikan jumlah tahi lalat sebanyak 2.5 untuk mendapatkan molarity: 0.0015 ÷ 2.5 =
0.0006 M
Maju sebanyak 1,000 untuk mendapatkan milimolar =
0.6 mM
Perhatikan bahawa anda mencapai hasil yang sama untuk milimolariti jika anda membahagikan jumlah milimol dengan jumlah penyelesaian.