Kandungan
- Kompaun dengan Konduktiviti Kukuh
- Kompaun dengan Konduktiviti Lemah
- Senyawa Tidak Merentas
- Konduktiviti Logam
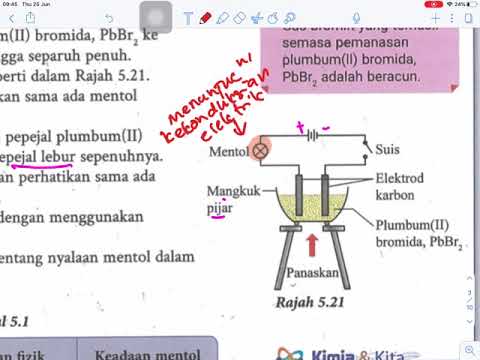
Sebatian yang mengendalikan arus dipegang bersama oleh daya elektrostatik atau tarikan. Ia mengandungi atom atau molekul bermuatan positif, dipanggil kation, dan atom atau molekul yang dikenakan negatif, dipanggil anion. Dalam keadaan pepejal mereka, sebatian ini tidak menjalankan elektrik, tetapi apabila dibubarkan di dalam air, ion-ion tersebut dapat dipisahkan dan boleh melakukan arus. Pada suhu tinggi, apabila sebatian ini menjadi cair, kation dan anion mula mengalir dan dapat menjalankan elektrik walaupun tanpa air. Sebatian nonionik, atau sebatian yang tidak berpecah menjadi ion, tidak menjalankan arus. Anda boleh membina litar mudah dengan mentol lampu sebagai penunjuk untuk menguji kekonduksian sebatian berair. Kompaun ujian dalam persediaan ini akan menyelesaikan litar dan menghidupkan mentol lampu jika ia dapat menjalankan arus.
Kompaun dengan Konduktiviti Kukuh
Cara yang paling mudah untuk menentukan sama ada sebatian boleh menjalankan arus adalah untuk mengenal pasti struktur atau komposisi molekulnya. Sebatian yang mempunyai kekonduksian yang kuat akan memisahkan sepenuhnya ke dalam atom atau molekul, atau ion, apabila dibubarkan di dalam air. Ion-ion ini boleh bergerak dan membawa semasa dengan berkesan. Semakin tinggi kepekatan ion, semakin besar kekonduksian. Garam jadual, atau natrium klorida, adalah contoh sebatian yang mempunyai kekonduksian yang kuat. Ia berpecah menjadi ion klorin natrium dan bermuatan negatif di dalam air. Amonium sulfat, kalsium klorida, asid hidroklorik, natrium hidroksida, natrium fosfat dan zink nitrat adalah contoh lain sebatian yang mempunyai kekonduksian yang kuat, juga dikenali sebagai elektrolit yang kuat.Elektrolit yang kuat cenderung menjadi sebatian anorganik, yang bermaksud bahawa mereka kekurangan atom karbon. Sebatian organik, atau sebatian karbon, selalunya lemah elektrolit atau tidak melucutkan.
Kompaun dengan Konduktiviti Lemah
Sebatian yang hanya memisahkan sebahagiannya dalam air adalah elektrolit yang lemah dan konduktor lemah arus elektrik. Asid asetik, sebatian yang terdapat di dalam cuka, adalah elektrolit yang lemah kerana ia hanya berpecah sedikit di dalam air. Ammonium hidroksida adalah contoh lain dari sebatian dengan kekonduksian yang lemah. Apabila pelarut selain daripada air digunakan, pemisahan ionik, dan oleh itu keupayaan untuk membawa arus, berubah. Pengionan elektrolit lemah biasanya meningkat dengan kenaikan suhu. Untuk membandingkan kekonduksian sebatian yang berbeza di dalam air, saintis menggunakan konduktansan tertentu. Konduktansian khusus adalah ukuran konduktiviti sebatian dalam air pada suhu tertentu, biasanya 25 darjah Celsius. Konduktansian spesifik diukur dalam unit siemens atau mikrosiemens per centimeter. Tahap pencemaran air boleh ditentukan dengan mengukur konduktansi tertentu, kerana air tercemar mengandungi lebih banyak ion dan boleh menghasilkan lebih banyak konduktans.
Senyawa Tidak Merentas
Sebatian yang tidak menghasilkan ion dalam air tidak dapat menjalankan arus elektrik. Gula, atau sukrosa, adalah satu contoh sebatian yang larut dalam air tetapi tidak menghasilkan ion. Molekul sukrosa yang dilarutkan dikelilingi oleh kluster molekul air dan dikatakan terhidrasi tetapi kekal tidak dikenakan. Sebatian yang tidak larut dalam air, seperti kalsium karbonat, juga tidak mempunyai kekonduksian: mereka tidak menghasilkan ion. Konduktiviti memerlukan kewujudan zarah yang dikenakan.
Konduktiviti Logam
Kekonduksian elektrik memerlukan pergerakan zarah yang dikenakan. Dalam kes elektrolit atau sebatian ion cair atau cair, zarah-zarah yang positif dan negatif dihasilkan dan boleh bergerak. Dalam logam, ion logam positif disusun dalam kisi atau struktur kristal yang tidak dapat bergerak. Tetapi atom logam positif dikelilingi oleh awan elektron yang bebas berkeliaran dan boleh membawa arus elektrik. Peningkatan suhu menyebabkan penurunan kekonduksian elektrik, yang bertentangan dengan peningkatan kekonduksian oleh elektrolit dalam keadaan yang sama.