Kandungan
Reaksi peneutralan terjadi apabila anda menggabungkan dua bahan yang sangat reaktif bersama untuk maksud menjadikannya tidak aktif, atau netral. Sebagai contoh, menggabungkan asid dan asas bersama menghasilkan air. Reaksi peneutralan memberi tenaga, yang dikenali sebagai haba peneutralan. Haba molar peneutralan adalah jumlah haba setiap tahi lalat yang ditambah kepada asid (atau sebaliknya) menyebabkan reaksi yang dikeluarkan. (Mol adalah ahli kimia unit yang digunakan untuk mewakili sebilangan besar molekul.) Apabila anda menentukan perubahan suhu yang berlaku, selebihnya mudah.
Timbang asid anda pada keseimbangan elektronik. Letakkan bikar kosong pada bakinya dan tekan butang Tare untuk membatalkan berat bikar itu, kemudian tuangkan asid anda ke dalam bikar dan letakkan pada baki. Catat jisim asid anda.
Kirakan perubahan suhu yang berlaku semasa tindak balas menggunakan calorimeter, sekeping peralatan yang kedua-duanya mengukur suhu dan memegang reaktan. Tambah asas anda ke kalorimeter dan letakkan asid anda (dalam bikarnya) di bawah mulut calorimeter. Masukkan termometer calorimeter ke dalam asid dan bacakan suhu awal. Tambah jumlah asas tindak balas anda menentukan asid anda, kemudian baca kalori anda untuk menentukan perubahan suhu.
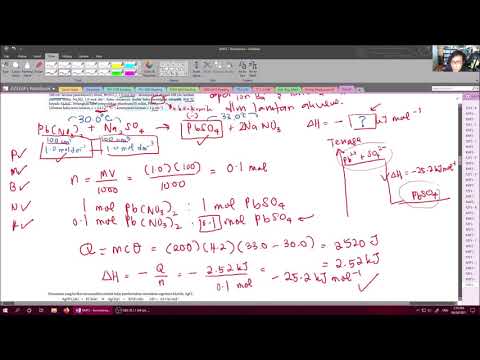
Kirakan haba peneutralan menggunakan fomula Q = mcΔT, di mana "Q" ialah haba peneutralan, "m" adalah jisim asid anda, "c" adalah kapasiti haba khusus untuk larutan akueus, 4.1814 Joules (gram x ° C), dan "ΔT" ialah perubahan suhu yang anda diukur menggunakan kalori anda. Sebagai contoh, jika anda mula dengan 34.5 gram asid hidroklorik pada suhu 26 ° C dan suhunya meningkat kepada 29.1 ° C apabila anda menambah natrium hidroksida, mengira haba peneutralan seperti berikut: Q = mcΔT = (34.5 gx 4.1814 J) ÷ ((gx ° C) x 3.1 ° C) = 447.48 Joule.
Kirakan bilangan tahi lalat asas yang anda tambah untuk menentukan haba molar peneutralan, dinyatakan menggunakan persamaan ΔH = Q ÷ n, di mana "n" adalah bilangan tahi lalat. Sebagai contoh, katakan anda menambah 25 mL 1.0 M NaOH ke HCl anda untuk menghasilkan haba peneutralan 447.78 Joule. (Perlu diingat bahawa 1.0 M bermakna satu mol setiap liter.) Oleh kerana anda menambah 25 mL (25/1000, atau .025 L) NaOH, tentukan tahi lalat sebagai berikut: 1.0 mol / L x .025 L = .025 mol. Dalam contoh ini, haba molar peneutralan, ΔH, ialah 447.48 Joule per .025 mol NaOH ditambah - 447.48 / .025, atau 17,900 Joule setiap mol.