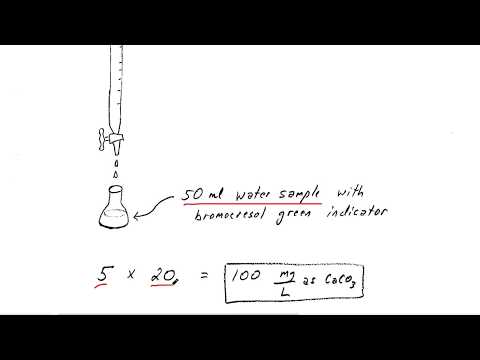
Ahli kimia kadangkala menggunakan titrasi untuk menentukan kealkalian bahan yang tidak diketahui. Istilah "alkalinity" merujuk kepada sejauh mana bahan adalah asas-kebalikan dari berasid. Untuk titrasi, anda menambah bahan dengan kepekatan yang diketahui-atau pH-kepada penyelesaian yang tidak diketahui satu titisan pada satu masa. Apabila penyelesaian penunjuk berubah warna untuk menunjukkan bahawa penyelesaian telah dinetralkan, mengira alkalinitas penyelesaian yang tidak diketahui adalah satu perkara yang mudah untuk menumbuk beberapa nombor ke dalam kalkulator.
Selesaikan titrasi anda dan tuliskan jumlah tetes yang diperlukan untuk meneutralkan penyelesaian.Sebagai contoh, bayangkan bahawa ia mengambil 40 titis 1 asid hidroklorik 1 Molar (M) untuk meneutralkan 0.5 liter (L) penyelesaian yang tidak diketahui.
Bahagikan bilangan titisan yang diperlukan untuk meneutralkan larutan sebanyak 20 untuk mendapatkan jumlah asid yang digunakan. Ini berfungsi kerana setiap 20 titik larutan berasaskan air kira-kira sama dengan 1 mililiter (mL).
Contoh: 40/20 = 2 mL
Bahagikan keputusan langkah sebelumnya sebanyak 1,000 untuk menukar mL ke L. Ini berfungsi kerana terdapat 1000 mL dalam L.
Contoh: 2/1000 = 0.002 L
Melipatgandakan hasil dari langkah terdahulu oleh molariti asid yang digunakan untuk menetap untuk mengetahui jumlah mol asid yang anda gunakan. Ingatlah bahawa dalam contoh kita, kita titrated dengan 1 M asid.
Contoh: 0.002 x 1 = 0.002 mol
Darahkan hasil dari langkah sebelumnya oleh setara moun ion hidrogen yang dihasilkan oleh asid yang anda gunakan. Ini sama dengan nombor selepas "H" dalam formula kimia asid. Asid sulfurik, H2SO4, akan mempunyai setara molar 2, contohnya. Kami menggunakan asid hidroklorik, atau HCl, yang, kerana tidak terdapat bilangan yang lebih besar di sana, mempunyai nombor yang diandaikan "1" selepas H.
Contoh: 0.002 x 1 = 0.002 bersamaan.
Bahagikan hasil dari langkah sebelumnya dengan volume, dalam liter, penyelesaian yang tidak diketahui asal anda untuk mendapatkan molariti ion hidroksida (OH-) dalam larutan itu.
Contoh: 0.002 / 0.5 = 0.004 M
Ambil asas log negatif 10 hasil daripada langkah sebelumnya untuk akhirnya mengira alkalinity, atau pOH, penyelesaian yang tidak diketahui.
Contoh: Alkalinitas penyelesaian yang tidak diketahui = pOH = -log = -log 0.004 = 2.4
Tukar kepada pH yang lebih biasa dengan mengurangkan hasil dari langkah sebelumnya dari 14.
Contoh: pH = 14 - pOH = 11.6
Penyelesaian yang tidak diketahui mempunyai pH 11.6.